Вчені з Каліфорнійського університету в Лос-Анджелесі виявили, що білок GPNMB, який виділяється певними імунними клітинами після серцевого нападу, відіграє ключову роль у загоєнні серця. Білок зв’язується зі специфічним рецептором, сприяючи відновленню тканин. Це відкриття може призвести до нових методів лікування, які запобігають серцевій недостатності шляхом підвищення здатності серця відновлюватися та ефективно функціонувати після серцевого нападу.
Вчені Каліфорнійського університету в Лос-Анджелесі визначили білок GPNMB як життєво важливий фактор у процесі загоєння серця після серцевого нападу.
Їхнє дослідження, проведене на тваринних моделях, показує, що імунні клітини кісткового мозку, звані макрофагами, вивільняють GPNMB, який зв’язується з рецептором, відомим як GPR39. Ця взаємодія сприяє відновленню тканин серця. Це дослідження пропонує новий погляд на природний процес загоєння серця та відкриває двері для потенційних методів лікування, спрямованих на покращення функції серця та запобігання прогресуванню серцевої недостатності.
У Сполучених Штатах кожні 40 секунд хтось переживає серцевий напад, що робить його основною причиною серцевої недостатності. Серцеві напади послаблюють серце і викликають рубці, зменшуючи його здатність ефективно перекачувати кров. Хоча ця рубцева тканина спочатку підтримує структуру серця, вона залишається назавжди, перевантажуючи решту м’язів і часто призводячи до серцевої недостатності з часом.
Потенціал GPNMB у лікуванні серцевої недостатності
Попередні клінічні дослідження показали, що GPNMB, або глікопротеїн не метастатичного протеїну меланоми В, був сильно пов’язаний із серцево-судинними наслідками в осіб із серцевою недостатністю. Однак не було зрозуміло, чи нестача білка безпосередньо відповідає за розвиток серцевої недостатності після серцевого нападу. Ця важлива відмінність — чи є GPNMB лише асоційованим біомаркером, чи тим, що відіграє причинну роль — визначає, чи можна вважати білок терапевтичною мішенню для майбутніх досліджень.
Використовуючи мишачі моделі, дослідники вперше встановили, що GPNMB не експресується самим серцем, а виробляється запальними клітинами, що походять із кісткового мозку. Після серцевого нападу ці макрофаги подорожують до місця пошкодження в серці, де вони експресують GPNMB.
Генетичні маніпуляції відкривають ключові ідеї
Команда провела генні нокаути — інактивувавши ген GPNMB — [AS1] і пересадивши кістковий мозок, і спостерігала, що миші без гена GPNMB демонстрували значно гірші результати після серцевого нападу, включаючи більшу частоту розривів серця, смертельного ускладнення, яке також спостерігається у людей хворі на серцеву недостатність. І навпаки, миші з нормальною експресією GPNMB, яким вводили додаткову дозу циркулюючого білка GPNMB, продемонстрували покращену функцію серця та зменшення рубців. Через чотири тижні після симуляції серцевого нападу у 67% тварин, у яких був відсутній ген GPNMB, спостерігався сильний фіброз або рубцювання, порівняно з лише 8% тварин у контрольній групі.
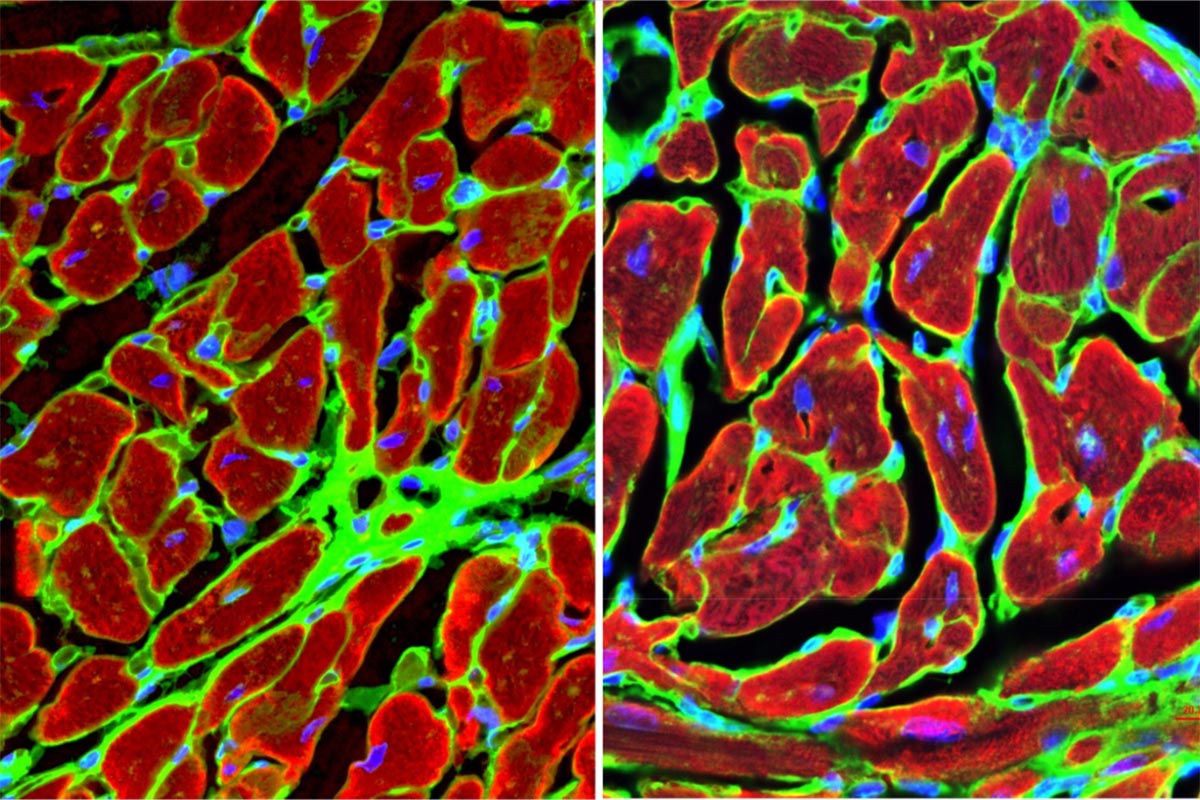
Відкриття нового шляху до регенерації тканин
На додаток до ідентифікації GPNMB як сигнальної молекули, яка впливає на різні типи клітин, дослідники виявили, що вона зв’язується з GPR39, який раніше вважався рецептором-сиротою, або рецептором, партнер зв’язування якого невідомий. Ця взаємодія запускає каскад сигналів, які сприяють регенерації тканин і обмежують утворення рубців.
Серцево-судинні захворювання, серед яких серцева недостатність є ускладненням на пізній стадії, є серйозною проблемою для здоров’я, на яку припадає приблизно одна третина всіх смертей у світі. Незважаючи на його поширеність, немає доступних методів лікування, які безпосередньо підвищують здатність серця відновлюватися після серцевого нападу. Нове дослідження демонструє потенціал GPNMB як терапевтичного засобу, а також GPR39 як мішені, що може обмежити утворення рубців, покращити роботу серця та запобігти серцевій недостатності.
Майбутні напрямки досліджень відновлення органів
Це дослідження також може мати ширші наслідки для розуміння відновлення тканин в інших органах. Оскільки GPNMB експресується в багатьох тканинах, майбутні дослідження вивчатимуть його роль у відновленні мозку, нирок та інших органів, уражених ішемічним ушкодженням. Дослідження було опубліковано в Nature Cardiovascular Research.
 718
718 






